Acide aminé
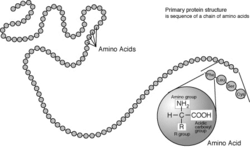
Un acide aminé est une molécule organique possédant un squelette carboné et deux fonctions : une amine et un acide carboxylique.
Recherche sur Google Images :
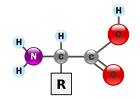
Source image : science-et-vie.net Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- petite molécule portant sur le même carbone une fonction acide -COOH, une fonction amine -NH2, un atome d'hydrogène et une chaîne latérale notée R (=radical). Il existe plus de 300 acides aminés dans la nature, ils se différencient par leur radical.... (source : premiumorange)
- composé chimique qui forme les «maillons» (monomères) des protéines (source : nzdl.sadl.uleth)
- constituant unitaire des protéines. Il en existe une vingtaine. Chaque protéine est caractérisée par le nombre d'acides aminés qui la forment et par la séquence particulièrement précise, rigoureusement définie, de ces derniers, réunis l'un à l'autre par une liaison peptidique.... (source : tpe-regimecretois.ifrance)
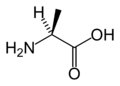
Un acide aminé est une molécule organique possédant un squelette carboné et deux fonctions : une amine (-NH2) et un acide carboxylique (-COOH). Les acides aminés sont les unités structurales de base des protéines. Ils mesurent à peu près 100 picomètres (pm).
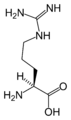
Les atomes de carbone de la chaîne carbonée sont ordonnés comparé au groupe carboxyle et appelés par une lettre grecque : l'atome de carbone directement lié au groupe carboxyle est le carbone α, et si le groupe amino est aussi sur ce carbone, c'est un acide carboxylique aminé en position α, c'est à dire un acide α-aminé. A titre d'exemple, la lysine est un acide α-aminé portant un deuxième groupe aminé en position ε.
Il existe plus de 100 acides α-aminés présents dans la nature, certains ont été découverts sur des météorites, surtout les chondrites carbonées. 22 acides aminés sont représentés dans le code génétique animal.
Dans la cellule, les acides aminés peuvent exister à l'état libre ou de biopolymères (peptides ou protéines). On peut ainsi distinguer différentes catégories d'acides aminés :
- Certains acides aminés sont retrouvés dans les protéines, et sont capables de participer in vivo à la synthèse de ces protéines. Ce sont par conséquent à la fois des constituants et des précurseurs des protéines.
- Certains acides aminés sont retrouvés dans les protéines seulement après leur biosynthèse (car ils ne se forment qu'après incorporation d'un autre acide aminé dans la molécule protéique).
- Certains acides aminés n'existent qu'à l'état libre. Quoiqu'il existe de nombreux acides aminés dans la nature, l'hydrolyse des protéines ou peptides naturels conduit à 20 acides aminés.
Ces acides aminés sont les «maillons» qui forment les protéines. Celles-ci sont identiques à des «colliers» constitués de cent à plusieurs milliers de ces «perles», reliées de manière covalente au moyen de fonctions amine et carboxylique (liaison peptidique). L'enchaînement des acides aminés forme la structure primaire des protéines. Cependant, ces dernières tirent leur propriétés de leur structure tertiaire, ou repliement spatial. Si le nombre d'acides aminés est inférieur à 20, on parle de peptide, et de 20 à 100 de polypeptide.
Sommaire
|
Structure générale
Les acides aminés naturels sont principalement des acides α-aminés répondant à la structure générale :
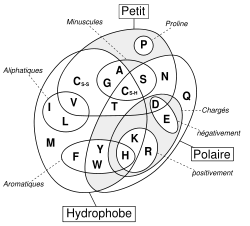
Le complexe ci-contre sans R est nommé radical ou chaîne principale, il est commun à l'ensemble des acides aminés. R représente une chaîne latérale spécifique à chaque acide aminé. Les acides aminés sont généralement classés selon les propriétés de la chaîne latérale en cinq groupes : acide, basique, neutre, hydrophile (polaire) ou hydrophobe (apolaire).
Isomérie
A part la glycine, où R = H, les acides aminés existent sous la forme de deux énantiomères, habituellement nommés D et L, selon que le groupe (-NH2) se trouve respectivement à droite ou à gauche dans la projection de Fischer. En l'occurrence, comme le substituant R a toujours un atome de carbone en position 1, les acides aminés L naturels ont une configuration absolue S alors que les D sont R.
Ces énantiomères sont optiquement actifs : chaque isomère dévie la lumière plane polarisée et est dextrogyre (+) ou lévogyre (-) suivant que la rotation du plan de polarisation de la lumière suit un sens horaire ou antihoraire. Il n'y a pas de corrélation entre le sens de rotation du plan de polarisation (ou pouvoir rotatoire) et la configuration de l'acide aminé : ainsi la L-alanine est lévogyre et se note L (-) -alanine. Par convention, il y a correspondance entre la représentation des oses et celle des acides aminés.
Les acides aminés L représentent la quasi totalité des acides aminés qui se trouvent dans les protéines. En effet, des enzymes dégradent les acides aminés dextrogyres qui pourraient être fatals, sauf dans certaines régions bien spécifiques (Ex : MP). [1] Certains de ces acides aminés, comme la thréonine, possèdent un 2e carbone asymétrique. Dans ce cas, le composé naturel est nommé L, les 2 autres stéréoisomères dont les positions relatives des substituants sont différentes sont nommés "allo". Ceux-ci ne sont pas présents dans les protéines. Les acides aminés D se rencontrent dans certaines protéines produites par des organismes exotiques au fond des océans, comme certains mollusques. Ce sont aussi des composants abondants des parois cellulaires des bactéries.
Propriétés générales
Solubilité
La plupart des acides aminés subissent aisément la solvatation par les solvants polaires tels que l'eau, ou l'alcool (spécifiquement proline et hydroxyproline) dans lesquels ils sont solubles. D'autre part, les acides α-aminés sont solubles, mais à moindre degré dans les solvants non polaires. Il est important de retenir que cette solubilité est beaucoup dépendante des propriétés de la chaîne latérale : la solubilité diminue avec le nombre d'atomes de carbone du radical, mais inversement augmente si ce radical R est porteur de fonctions polaires (NH2, COOH) ou hydrophiles (OH). Ex de solubilité : La tyrosine, par son noyau aromatique, est peu soluble dans l'eau : 0, 04 %. De même, la cystéine, la leucine.
Propriétés ioniques
Les acides aminés contiennent un groupement carboxyle -COOH acide et un groupement amino -NH2 basique. En solution, ces groupements existent sous deux formes, l'une chargée, l'autre neutre :
R-COOH ; R-COO- + H+
R-NH3+ ; R-NH2 + H+
Les acides aminés sont nommés pour cette structure diionique amphotères. L'ionisation fluctue avec le pH : les acides aminés existent, en solution aqueuse, sous 3 formes envisageables :
a) En milieu acide (pH
b) En milieu basique (pH>pHi) : La fonction acide s'ionise en libérant un proton, la base du milieu bloque l'ionisation du groupement amino. L'acide carboxylique se trouve sous forme d'anion.
c) Le pH pour lequel les 2 dissociations s'effectuent est nommé point isoélectrique : ou pHi. À ce pH, on a un ion dipolaire ou zwitterion de charge nette nulle, par conséquent ne migrant pas dans un champ électrique.
De part et d'autre du pHi, on définit des pH qui correspondent à une demi dissociation de COOH et de NH3+, ce sont les pKs. Il existe par conséquent 2 pK :
- le pK de COOH : à peu près 2 - 3
- le pK de NH3+ : à peu près 10
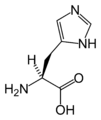
Le point (ou pH) isoélectrique ou isoionique est égal à la demi somme des pKs. Le radical R, quand il renferme un groupe ionisable, participe à la valeur du point isoélectrique. Un pK supplémentaire apparaît alors. Par exemple pour l'histidine :
- pK1 acide
- pK2 demi dissociation du groupe imidazole
- pK3 amine
Absorption de la lumière
Les solutions d'acides aminés sont incolores. Les acides aminés aromatiques absorbent dans l'UV entre 260 et 280 nm. Au-dessus de 260 nm, la plus grande partie de l'absorption ultraviolette des protéines provient de leur teneur en tryptophane et quelquefois en tyrosine.
Propriétés du groupe carboxyle
Amidation
Le carboxyle peut former des amides avec les amines.
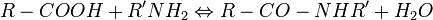
Asparagine et glutamine sont deux exemples de dérivés physiologiques constitués suivant cette réaction. L'amidation peut être obtenue in vitro en utilisant des carbodiimides (R1-N=C=N-R2). Le groupe carboxyle est dans une première étape activé par la carbodiimide, puis le dérivé activé ainsi constitué réagit avec l'amine.
Décarboxylation
Chimique ou enzymatique par une décarboxylase. Décarboxylation sous forme de CO2. Les décarboxylases sont spécifiques de chaque acide aminé. La décarboxylation est importante en biochimie car elle aboutit aux «amines biologiques» correspondantes particulièrement actives :
Exemples :
- Histidine décarboxylée en histamine (choc, allergie) ;
- 5OH tryptophane décarboxylée en sérotonine (hypertension).
Propriétés du groupement amino
Ce sont des propriétés générales d'amines primaires. Deux types de groupes aminos peuvent être distingués : les amines en alpha et l'amine en epsilon de la chaîne latérale de la lysine dont le pK est un peu plus basique (>8). La différence des valeurs de pK est parfois utilisée pour des modifications sélectives, en contrôlant le pH du milieu réactionnel.
Acétylation
L'acétylation des groupements aminos des acides aminés par l'anhydride acétique diminué leurs charges positives et change leurs interactions avec les composants de l'environnement.
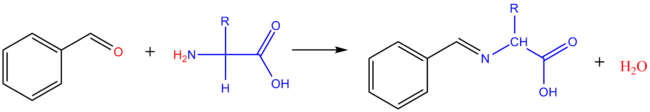
Réaction avec les aldéhydes
Avec les aldéhydes aliphatiques : il se forme le dérivé diméthylol de l'acide aminé. Avec les aldéhydes aromatiques, on obtient des bases de Schiff.
Une réaction du même type peut se produire in vivo entre acides aminés et oligosaccharides (réaction de glycation des protéines avec les résidus d'acides aminés ayant une fonction amine libre). Dans les enchainements saccharidiques, le sucre réducteur terminal existe de façon prédominante sous forme cyclique, avec uniquement des traces sous forme ouverte. Une base de Schiff peut se former avec cette forme minoritaire, déplaçant ainsi l'équilibre entre les deux formes vers la forme ouverte.
In vitro, cette réaction avec les saccharides est le plus souvent réalisée en présence de cyanoborohydrure de sodium (NaCNBH3). La base de Schiff constituée est ainsi rapidement réduite par les anions cyanoborohydrides en amine secondaire plus stable.
Arylation
La substitution d'un H de la fonction NH2 par un groupement aryle (aromatique) conduit à une fonction amine secondaire. Par exemple avec le dinitro-fluoro-benzène (réactif de Sanger) il se forme un dinitrophényl-acide aminé coloré, par conséquent dosable. Cette réaction peut se produire quand l'acide aminé est incorporé dans une protéine. Si on hydrolyse une protéine on libère des acides aminés et des DNP acides aminés correspondant aux acides aminés dont les groupes NH2 sont libres dans la protéine (terminaux).
Cette réaction a permis à Frederick Sanger (en 1953) d'établir la première structure primaire d'une protéine (l'insuline).
Carbamylation
Elle a lieu avec les isocyanates, surtout le phénylisothiocyanate (PITC).
Le PITC est spécifiquement utilisé pour déterminer l'enchaînement des acides aminés dans les chaînes peptidiques. Le phénylthiocarbamyl-aminoacide (PTC-AA) résultant est un composé caractéristique de chaque acide aminé (nature du groupement R). Il est particulièrement stable et détectable dans l'ultraviolet (245 nm).
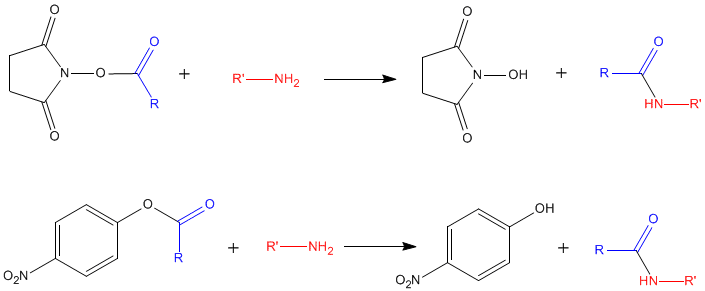
Réactions avec des esters de N-hydroxysuccinimide et de para-nitrophényl
Ces réactions permettent le greffage d'un groupement R sur le -NH2 d'un acide aminé, avec élimination du groupement réactif : c'est l'hydroxysubstitution
Ces réactions sont utilisées pour la synthèse de dérivés d'acides aminés ou de protéines "marquées" sur leurs fonctions amines libres (dérivés fluorescents, biotinylation par la biotine-N-hydroxysuccinimide, ... ) ; pour la synthèse de supports chromatographiques par greffage d'acides aminés ou de protéines, ...
Propriétés dues à la présence simultanée du -COOH et du -NH2
Formation de complexes métalliques (chélation)
Ces chélates stables sont utilisés pour effectuer des réactions chimiques au niveau de R, en synthèse.
Décarboxylation et désamination oxydatives. Réaction avec la ninhydrine
Certains oxydants attaquent l'acide aminé et réalisent une désamination associée à une décarboxylation. Au cours de la réaction il y a production de CO2, de NH3 et d'un aldéhyde ayant un atome de carbone de moins que l'acide aminé dont il provient.
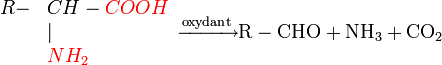
Les oxydants sont variés : eau oxygénée, hypochlorite etc. Pour rendre cette réaction quantitative, on peut doser CO2 par alcalimétrie ou NH3 par colorimétrie. L'oxydant le plus utilisé est la ninhydrine (voir la page correspondante).
Quand un acide aminé en solution est chauffé en présence de ninhydrine en excès, il conduit à un chromophore avec un maximum d'absorption à 570 nm (bleu-violet). L'intensité de la coloration est à la base d'une méthode quantitative pour doser les acides aminés. La réaction s'effectue en 3 étapes. La 1re correspond à l'action d'une première molécule de ninhydrine sur l'acide aminé conduisant à un iminoacide ainsi qu'à une molécule de ninhydrine réduite. La 2e correspond à l'action d'une 2e molécule de ninhydrine sur l'iminoacide pour donner un aldéhyde. Cette 2e molécule se condense finalement avec la molécule de ninhydrine réduite pour former le chromophore.
La coloration n'est pas spécifique des acides aminés. Elle se produit avec d'autres composés ayant des groupements aminos libres : glucosamine, peptides et protéines. Cette méthode colorimétrique est une bonne technique pour le dosage d'un acide aminé pur, mais elle est moins valable pour un dosage global car les acides aminés réagissent en donnant des colorations d'intensité variable. Les iminoacides donnent avec la ninhydrine, une coloration jaune.
Métabolisme
Du point de vue métabolique, on distingue les acides aminés indispensables pour l'homme des autres : ce sont des acides aminés qui ne peuvent être synthétisés dans les cellules humaines et qui doivent par conséquent être apportées par l'alimentation.
Quand les protéines se décomposent dans l'intestin, les acides aminés sont "libérés" du "collier". Ainsi, ils peuvent pénétrer la paroi intestinale. Ils se mélangent ensuite à d'autres acides aminés (surtout ceux provenant des protéines corporelles dégradées) pour former le "pool des acides aminés". De ce "pool" sont choisis les acides aminés dont l'organisme a besoin pour synthétiser les protéines qui lui manquent. Une fois choisis, ils sont liés dans le ribosome des cellules qui, eux, déterminent l'ordre des différentes "perles" à partir de l'information détenue dans l'ADN. D'autres acides aminés du "pool" sont aussi utilisés pour produire du glucose et des
Liste des principaux acides aminés
Liste des 22 acides aminés représentés dans le code génétique
| Nom | Code à 1 lettre |
Code à 3 lettres |
Masse molaire (g. mol-1) |
pI | pKa1 (-COOH) | pKa2 (-NH2) | pKaR (-R) | Abondance relative[2] |
|---|---|---|---|---|---|---|---|---|
| Alanine | A | Ala | 89, 09 | 6, 11 | 2, 35 | 9, 87 | 7, 86 | |
| Arginine | R | Arg | 174, 20 | 10, 76 | 1, 82 | 8, 99 | 12, 48 | 5, 39 |
| Asparagine | N | Asn | 132, 12 | 5, 41 | 2, 14 | 8, 72 | 4, 15 | |
| Aspartate | D | Asp | 133, 10 | 2, 85 | 1, 99 | 9, 90 | 3, 90 | 5, 34 |
| Cystéine | C | Cys | 121, 16 | 5, 05 | 1, 92 | 10, 70 | 8, 18 | 1, 51 |
| Glutamate | E | Glu | 147, 13 | 3, 15 | 2, 10 | 9, 47 | 4, 07 | 6, 66 |
| Glutamine | Q | Gln | 146, 15 | 5, 65 | 2, 17 | 9, 13 | 3, 95 | |
| Glycine | G | Gly | 75, 07 | 6, 06 | 2, 35 | 9, 78 | 6, 94 | |
| Histidine | H | His | 155, 16 | 7, 60 | 1, 80 | 9, 33 | 6, 04 | 2, 29 |
| Isoleucine | I | Ile | 131, 17 | 6, 05 | 2, 32 | 9, 76 | 5, 91 | |
| Leucine | L | Leu | 131, 17 | 6, 01 | 2, 33 | 9, 74 | 9, 64 | |
| Lysine | K | Lys | 146, 19 | 9, 60 | 2, 16 | 9, 06 | 10, 54 | 5, 93 |
| Méthionine | M | Met | 149, 21 | 5, 74 | 2, 13 | 9, 28 | 2, 37 | |
| Phénylalanine | F | Phe | 165, 19 | 5, 49 | 2, 20 | 9, 31 | 3, 97 | |
| Proline | P | Pro | 115, 13 | 6, 30 | 1, 95 | 10, 64 | 4, 81 | |
| Pyrrolysine | O | Pyl | 255, 3134 | |||||
| Sélénocystéine | U | Sec | 168, 053 | 5, 2 | ||||
| Sérine | S | Ser | 105, 09 | 5, 68 | 2, 19 | 9, 21 | 6, 83 | |
| Thréonine | T | Thr | 119, 12 | 5, 60 | 2, 09 | 9, 10 | 5, 41 | |
| Tryptophane | W | Trp | 204, 23 | 5, 89 | 2, 46 | 9, 41 | 1, 14 | |
| Tyrosine | Y | Tyr | 181, 19 | 5, 64 | 2, 20 | 9, 21 | 10, 46 | 3, 04 |
| Valine | V | Val | 117, 15 | 6, 00 | 2, 39 | 9, 74 | 6, 73 |
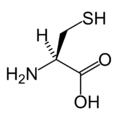
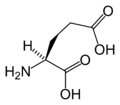
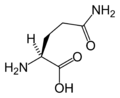
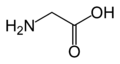
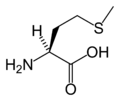
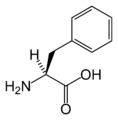
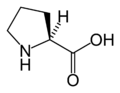
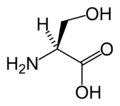
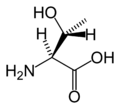
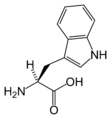
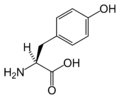
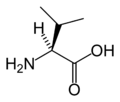
Structure des 20 acides aminés standards représentés dans le code génétique
|
Présence et fonctions en biochimie
Acides aminés standards
Les acides aminés sont les unités de base de construction des protéines. Ils forment soit des chaînes courtes d'acides aminés nommés peptides (si la chaîne est inférieure à 50 acides aminés) soit des chaînes longues nommées polypeptides ou des protéines (si la chaîne est supérieure à 50 acides aminés). Ces polymères sont linéaires et non ramifiés. Le processus de fabrication des protéines est nommé traduction et se fait par ajouts successifs d'acides aminés à une protéine en cours de construction par une chaîne de ribozymes qu'on nomme un ribosome[3]. L'ordre dans lequel les acides aminés sont ajoutés est déterminé par le code génétique de l'ARNm qui est une copie d'ARN de l'un des gènes de l'organisme. Vingt acides aminés sont codés par le code génétique standard et sont nommés acides aminés standards.
Notes et références
- ↑ Uwe Meierhenrich, Amino acids and the asymmetry of life, Springer-Verlag, 2008. ISBN 978-3-540-76885-2
- ↑ Swiss-Prot
- ↑ Rodnina MV, Beringer M, Wintermeyer W, How ribosomes make peptide bonds, vol. 32, 2007
Voir aussi
- Classement thématique des neurosciences
- Maladie génétique du métabolisme des acides aminés
- Nutriments essentiels
Liens externes
|
Acide aminé |
| Ala | Arg | Asn | Asp | Cys | Glu | Gln | Gly | His | Ile | Leu | Lys | Met | Phe | Pro | Ser | Thr | Trp | Tyr | Val |
| Acide aminé essentiel | Protéine | Peptide | Code génétique |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

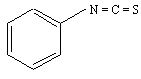

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité